
Problem w tym, że poddane weryfikacji produkty, często budzące wątpliwości GIS, mogły być przez czas kontroli dostępne na rynku. Sprzedaż takich produktów można rozpocząć z chwilą złożenia w Głównym Inspektoracie Sanitarnym powiadomienia o wprowadzeniu lub zamiarze wprowadzenia na rynek nowego suplementu. Z danych NIK wynika natomiast, że czas wyjaśniania, czy jest on bezpieczny trwa, od trzech miesięcy do ponad trzech lat. Niektóre z postępowań jasno wykazały, że badane suplementy diety nie spełniają norm i nie powinny być sprzedawane jako środki spożywcze (4 na 7 zbadanych przez NIK).
Duża skala nieprawidłowości dotyczyła także sprzedaży internetowej. Kontrolerzy Izby zidentyfikowali w sieci suplementy diety z niedozwolonymi składnikami, które mogły stanowić zagrożenie dla zdrowia. Ich stosowanie w żywności jest niedozwolone i według GIS mogą zagrażać bezpieczeństwu konsumentów to: MK-677 - Ibutamoren, johimbina, androsta-3,5-diene-7,17- Dione, konopie włókniste, świerzbowiec właściwy, DMHA, ostarine (MK-2866), DHEA, 5-HTP (hydroksytryptofan). Zdaniem Głównego Inspektora Sanitarnego przedsiębiorcy, którzy oferowali te produkty, w większości przypadków nie dopełnili obowiązku ich zgłoszenia, wprowadzili je na rynek nielegalnie.
Przeczytaj również: Rynek suplementów diety na najwyższym poziomie w historii
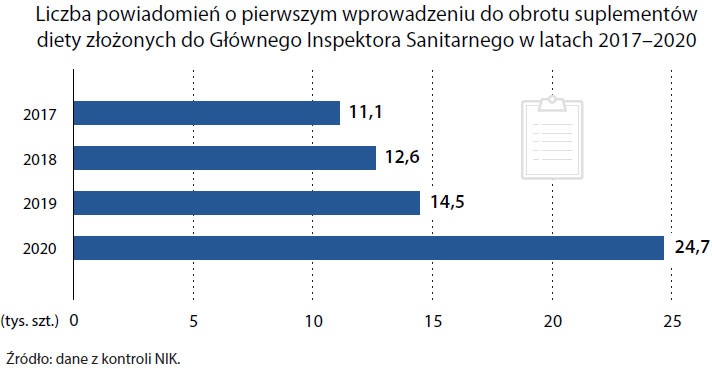
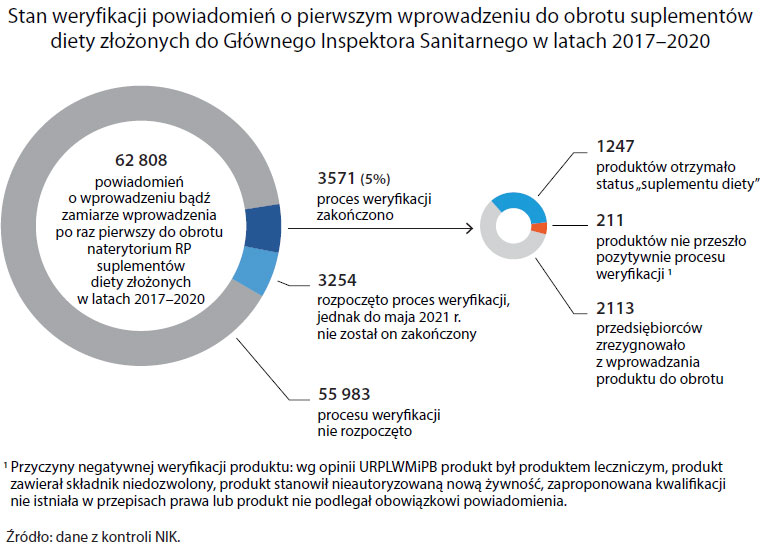
Mocno wzrosła też popularności suplementów diety. W latach 2013-2015 zgłoszono w GIS w sumie od 9 do 12 tys. nowych suplementów diety (3-4 tys. rocznie). W latach 2017-2020 było to już 62 808. Wzrost popularności tych produktów nie wiąże się jednak ze wzrostem świadomości Polaków na temat tego, czym one są i czym się różnią od leków OTC, czyli sprzedawanych bez recepty.
Wyniki kontroli
W badanym przez NIK okresie, organy Państwowej Inspekcji Sanitarnej kontrolowały co roku niemal 80 proc. wytwórni suplementów diety i ok. 40 proc. hurtowni oferujących te produkty. W sumie wydano 437 decyzji nakazujących wycofanie ze sprzedaży suplementu diety, zakazujących sprzedaży bądź czasowo wstrzymujących sprzedaż. Część z tych decyzji dotyczyła różnych produktów tych samych producentów, których w tej sytuacji obejmowano wzmożonym nadzorem sanitarnym.
Kontrolerzy NIK wybrali losowo 8 rozpatrywanych już przez pracowników GIS powiadomień. Okazało się, że okres, jaki upłynął od dnia, w którym rozpoczęto weryfikację do dnia kontroli, wynosił od 851 dni do ponad 3 lat, a w jednym przypadku ponad 13 lat i 10 miesięcy. Opóźnienia dotyczyły także samego rozpoczęcia postępowania wyjaśniającego i wynosiły od 10 dni do niemal trzech lat.
Do tego w pismach zobowiązujących przedsiębiorców do przedstawienia naukowych opinii na temat sprzedawanego suplementu nie wskazywano terminu ich dostarczenia. Kontrolerzy NIK przeanalizowali 14 postępowań – w żadnym z nich nie dostarczono wymaganej opinii, w dwóch producenci zrezygnowali z wprowadzenia na rynek zgłaszanych produktów, a w pozostałych sprawach GIS nie ponaglał i nie egzekwował nałożonych na przedsiębiorców obowiązków. Przez ten czas analizowane suplementy można było legalnie kupić.
Dlaczego to tyle trwa?
Zdaniem Głównego Inspektora Sanitarnego przyczynami opóźnień w weryfikacji powiadomień były głównie: znaczący wzrost liczby powiadomień składanych przez przedsiębiorców w poszczególnych latach. W ocenie NIK najistotniejszą przyczyną opóźnień i niskiej efektywności były jednak braki kadrowe. Rozpoczęta w Państwowej Inspekcji Sanitarnej w lutym 2020 r. modyfikacja systemu informatycznego usprawniło wstępne sprawdzanie powiadomień o wprowadzeniu lub zamiarze wprowadzenia na rynek suplementów diety, ale nawet w przypadku wdrożenia pełnej informatyzacji systemu powiadamiania, co jest planowane na koniec 2023 r., niezbędne będzie zatrudnienie w GIS nowych pracowników.
Konieczna zmiany przepisów
NIK ma zastrzeżenia do kontroli rynku suplementów diety. Kolejni ministrowie zdrowia przyjmowali, że ryzyko z nim związane jest niewielkie, dlatego nie identyfikowali potencjalnych zagrożeń, a tym samym nie mogli im zapobiegać, ani ich eliminować.
O tym, że rynek suplementów diety wymaga szczególnego nadzoru, NIK przekonywała już po kontroli w 2016 r. Izb proponowała wówczas m.in. zmianę systemu notyfikacji, czyli powiadamiania Głównego Inspektora Sanitarnego przez producenta o wprowadzeniu na rynek takiego produktu lub zamiarze wprowadzenia, pobieranie opłat za notyfikację, a także stworzenie systemu ostrzegania konsumentów przed znajdującymi się na runku suplementami, które nie zostały oficjalnie zgłoszone w GIS. NIK uznała też za konieczne wydzielenie z rejestru tych suplementów diety, które są weryfikowane ze względu na wątpliwości co do ich bezpieczeństwa, proponowała również podwyższenie kar pieniężnych za wprowadzanie na rynek niebezpiecznych lub nielegalnych suplementów diety oraz za nieprzestrzeganie wymagań w zakresie m.in. reklamy i promocji.
Celem najnowszej kontroli było więc sprawdzenie, czy w latach 2017-2020 organy odpowiedzialne za nadzór nad wprowadzanymi na rynek suplementami diety, zapewniły konsumentom odpowiedni poziom bezpieczeństwa zdrowotnego. Zdaniem Izby tak się nie stało.








