Jak ustrzec się przed spóźnialskimi bądź niesłownymi klientami? Jak zabezpieczyć swój salon by nie być stratnym jako przedsiębiorca kiedy tracimy zaplanowaną wizytę? Zdradzimy Wam kilka sposobów na Waszą spokojną, przedsiębiorczą głowę oraz przede wszystkim niestratny portfel.
Zabieg kosmetyczny – rodzaj umowy
Zacznijmy od tego, że w większości przypadków każdy zabieg kosmetyczny jest powszechnie znaną umową o dzieło, która to zostaje zawarta w reżimie obowiązujących przepisów Kodeksu cywilnego. Zgodnie z art. 627 Kodeksu cywilnego przez umowę o dzieło przyjmujący zamówienie zobowiązuje się do wykonania oznaczonego dzieła, a zamawiający do zapłaty wynagrodzenia.
Taka właśnie sytuacja ma miejsce pomiędzy Tobą, drogi przedsiębiorco sektora Beauty, a Twoimi klientami. Z racji na powyższe, możemy śmiało wywnioskować, że to właśnie Ty jesteś stroną przyjmującą zamówienie, a Twój klient przyjmuje „rolę” zamawiającego. W konsekwencji, do łączącego Was stosunku prawnego stosować będziemy przepisy określone właśnie dla umowy o dzieło, patrz art. 627 Kodeksu cywilnego i późn.
Co wyróżnia umowę o dzieło? Dość charakterystycznym czynnikiem dla tak ukształtowanego stosunku prawnego jest tzw. efekt, bowiem umowa o dzieło jest typowym przykładem umowy rezultatu. Ten właśnie rezultat jest czynnikiem w znacznym stopniu różnicującym umowę o dzieło od stosunku zlecenia. Co więc zrobić, aby w ogóle doszło do wykonania danej usługi i aby faktycznie umówiony klient pojawił się w naszym salonie?
Zadatek czy zaliczka? Czym się różnią?
Zadatek
Dla większości z Was brzmi groźnie. Powód? Potencjalne odstraszenie nowych klientów, zniechęcenie przyszłego odbiorcy, niepewność klienta co do jakości ekwiwalentu w postaci usługi, a tym bardziej finalnego jej efektu. Nic bardziej mylnego! Dzięki zadatkowi, instytucji ugruntowanej w orzecznictwie i praktyce licznych przedsiębiorstw, jako właściciele firm, jesteśmy w stanie zabezpieczyć swoje portfele, mieć pod kontrolą wszelkie koszty nieodbytego finalnie zabiegu oraz przede wszystkim uzyskać choć część zwrotu za zarezerwowane roboczogodziny naszej firmy.
W tym miejscu należy szerzej powiedzieć o tym, co wchodzi w skład kosztów jakie ponosimy, gdy umówiony zabieg nie dochodzi do skutku z winy klienta.
- koszt pracownika – roboczogodziny przeznaczone na wykonanie danego zabiegu oraz oczywiście koszt funkcjonowania recepcji, jeśli taką posiadamy,
- koszt czasu przeznaczonego na przygotowanie gabinetu – weźmy pod uwagę zarówno jego przygotowanie jak i późniejsze posprzątanie, a więc doprowadzenie nawet po nieodbytej usłudze do stanu bazowego,
- koszt przygotowanych kosmetyków – ten koszt pojawia się jedynie w przypadku wcześniejszego przygotowania jednorazowych kosmetyków, np. indywidualnie otwartych jednorazowych produktów, ampułek, otwartych narzędzi, olejów itp.,
- utracone korzyści – czynnik budzący największe kontrowersje, bowiem to on jest najbardziej dotkliwy. Przejawia się w potencjalnej możliwości przyjęcia na miejsce niesłownego klienta, innych zainteresowanych osób, nierzadko w usługach o wiele droższych niż ta, która została zaplanowana,
- media – np. koszt ogrzania danego gabinetu, koszty wcześniejszego ogrzania sauny etc.,
- proporcjonalny koszt najmu części lokalu, w której miał odbyć się dany zabieg,
- koszt systemów rezerwacyjnych, w przypadku pobrania prowizji nawet za nieodbyty zabieg.
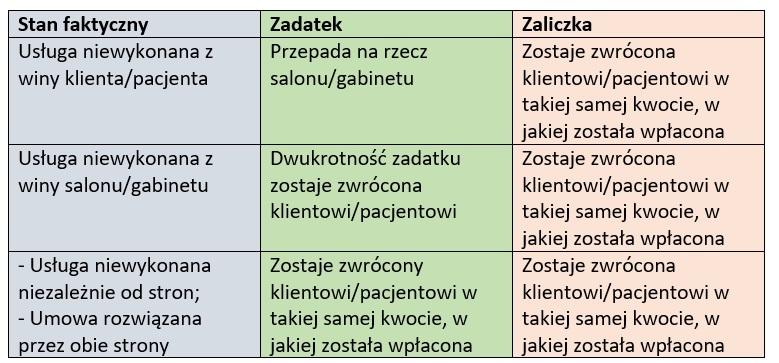
Zgodnie z przepisami Kodeksu cywilnego, w braku odmiennego zastrzeżenia umownego albo zwyczaju, zadatek dany przy zawarciu umowy ma to znaczenie, że w razie niewykonania umowy przez jedną ze stron druga strona może bez wyznaczenia terminu dodatkowego od umowy odstąpić i otrzymany zadatek zachować, a jeżeli sama go dała, może żądać sumy dwukrotnie wyższej.
Co istotne, w razie wykonania umowy, zadatek ulega zaliczeniu na poczet świadczenia strony, która go dała. Jeżeli zaliczenie nie jest możliwe, zadatek ulega zwrotowi.
W razie rozwiązania umowy zadatek powinien być zwrócony, a obowiązek zapłaty sumy dwukrotnie wyższej odpada. To samo dotyczy wypadku, gdy niewykonanie umowy nastąpiło wskutek okoliczności, za które żadna ze stron nie ponosi odpowiedzialności albo za które ponoszą odpowiedzialność obie strony.
Konkludując, osoba faktycznie zainteresowana odbyciem określonego zabiegu w Waszym salonie, nie będzie wahała się w kwestii uiszczenia zadatku, będzie dla niej bowiem jasne, że wcześniej wpłacona kwota zostanie zaliczona na poczet przyszłej, znanej ceny. Jednym słowem, ten kto naprawdę chce skorzystać z Waszych usług, zapłaci.
Zaliczka
Podobnie jak zadatek, zaliczka jest pewnym rodzajem zabezpieczenia przedsiębiorcy jednak nigdy aż tak skutecznym jak ten pierwszy. Wynika to między innymi z faktu braku odpowiedniej regulacji w przepisach prawa a jedynie w orzecznictwie, zazwyczaj poświęconym wskazaniu różnic pomiędzy niniejszymi dwoma zagadnieniami. Jak więc w precyzyjny sposób określić główne różnice pomiędzy zadatkiem a zaliczką? Mamy nadzieję, że poniższa tabela pomoże w ich zrozumieniu.
Zadatek a zaliczka. Co jest korzystniejsze dla przedsiębiorcy?
W odróżnieniu do zadatku, potraktujmy zaliczkę bardziej jako opłatę za tzw. rezerwację określonego terminu w naszym kalendarzu niż pełnoprawne zabezpieczenie stron.
Szczera rozmowa z klientem
Najmniej skuteczna metoda zabezpieczenia przed niesłownymi odbiorcami naszych usług, jednak nierzadko efektywna, w szczególności, kiedy po drugiej stronie mamy do czynienia z osobami świadomymi. Jest to sposób najbardziej adekwatny w przypadku stałych klientów, kiedy za nawiązaną już wcześniej współpracą, stoi wzajemne zaufanie i długotrwała więź między klientem a salonem.
Na marginesie należy dodać, iż w dobie wszechobecnego Internetu i innych podobnych narzędzi, niezwykle łatwym dla konkurencyjnych działalności jest coraz to częściej spotykane umawianie fikcyjnych wizyt dla zapełnienia kalendarza potencjalnego rynkowego rywala. Takie działanie jest rozpatrywane w kategorii czynów nieuczciwej konkurencji i zdecydowanie nie zasługuje na ochronę prawną.
Mec. Jagoda Rusińska, radca prawny z 9-letnim doświadczeniem pracy w kancelarii prawnej. Specjalizuje się w salonach beauty, kosmetologii i medycyny estetycznej. Jest autoryzowanym radcą prawnym Beauty Razem i szefem kancelarii Beauty Law.