
 – W Europie Środkowo-Wschodniej nie ma dominującego modelu organizacji rynków aptecznych, niemniej cztery państwa, w tym Polska, podąża bezprecedensową ścieżką zacieśniania regulacji. A im więcej regulacji, tym gorzej dla pacjentów – dowodził w swojej prezentacji mec. Marcin Tomasik z kancelarii TJSP, przedstawiciel ZPA PharmaNET podczas konferencji Europejskiej Federacji Sieci Aptecznych (EFPC) „Opieka farmaceutyczna – poza pandemią”.
– W Europie Środkowo-Wschodniej nie ma dominującego modelu organizacji rynków aptecznych, niemniej cztery państwa, w tym Polska, podąża bezprecedensową ścieżką zacieśniania regulacji. A im więcej regulacji, tym gorzej dla pacjentów – dowodził w swojej prezentacji mec. Marcin Tomasik z kancelarii TJSP, przedstawiciel ZPA PharmaNET podczas konferencji Europejskiej Federacji Sieci Aptecznych (EFPC) „Opieka farmaceutyczna – poza pandemią”.
Wykazał, że Europa nie jest monolitem legislacyjnym pod względem organizacji rynków aptecznych, liczby
i zasad funkcjonowania aptek. Prawodawstwo europejskie jest w tym zakresie bardzo zróżnicowane
oraz uwarunkowane historycznie i kulturowo. Nie ma więc wyraźnego schematu rozwoju rynku aptecznego.
Jedne państwa, jak Wielka Brytania, Irlandia, Holandia, Szwajcaria, Norwegia, Szwecja, to wdług prelegenta przykłady rynków liberalnych, z tendencję do ich otwierania w celu poprawy dostępności do leków i usług aptecznych. W innych krajach, jak w Hiszpanii, Austrii czy Francji, utrzymuje się wysoki poziom ingerencji państwa w rynek.
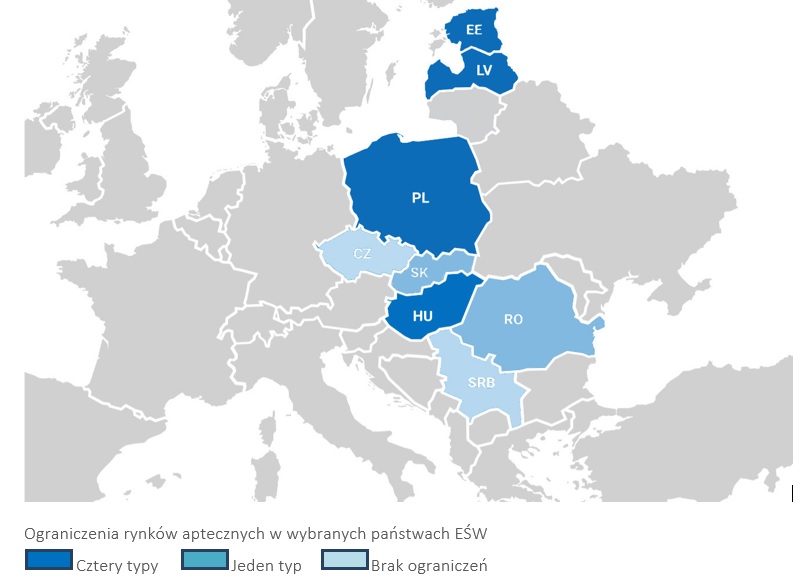
– Jednak nawet tam, gdzie rynek apteczny jest ściśle regulowany, występuje najczęściej jeden lub dwa typy obostrzeń, z licznymi wyjątkami. Tymczasem w czterech państwach Europy Środkowo-Wschodniej, tj. w Polsce, na Węgrzech oraz w Łotwie i Estonii, w ciągu ostatniej dekady wprowadzono aż cztery typy obostrzeń łącznie – powiedział mec. Marcin Tomasik.
W swojej prelekcji, podczas panelu zatytułowanego „Regulacje i innowacje” wykazał, że w ostatnich latach obraz rynku aptecznego w regionie uległ istotnej zmianie. Część krajów zdecydowała się zliberalizować regulacje dotyczące kształtu i wielkości rynku aptecznego – np. Czechy, Rumunia, Słowacja, Serbia – podczas gdy inne obrały ostry kurs, wprowadzając liczne ograniczenia o charakterze ilościowym, własnościowym, demograficznym i geograficznym.
– Na Węgrzech i Łotwie ten kierunek jest kontynuowany od mniej więcej dekady, podczas gdy w Polsce i Estonii restrykcyjne regulacje rynków aptecznych pojawiły się dopiero w kilku ostatnich latach. Sytuacja, gdy aż cztery typy ograniczeń rynkowych występują jednocześnie, rodzi pytania o zasadność i możliwe skutki takiego przeregulowania – przestrzegał przedstawiciel ZPA PharmaNET.
Zakaz jakiejkolwiek komunikacji z pacjentem
Jego wystąpienie pokazało też, że ewenementem w regionie jest obowiązujący tylko w Polsce całkowity zakaz reklamy aptek, który przybrał formę zakazu jakiejkolwiek komunikacji apteki czy farmaceuty z pacjentami.
– Tak surowe ograniczenia aktywności informacyjnej aptek – przypomnijmy, że w połączeniu z bardzo szerokimi restrykcjami ilościowo-własnościowymi – nie obowiązują nigdzie w Europie. Zasadnym wydaje się więc pytanie, czy wprowadzenie aż tylu obostrzeń jednocześnie jest uzasadnione i proporcjonalne – mówił mec. Tomasik.
Podał przykład Irlandii, gdzie w 1996 roku wprowadzono system, który ograniczał powstawanie nowych aptek. Głównymi beneficjentami regulacji ograniczających rynek stały się już działające apteki, ale nie pacjenci, dla których dostęp do placówek, jakość serwisu oraz ceny samych leków uległy pogorszeniu. W rezultacie już w 2002 roku ponownie zliberalizowano rynek, znosząc wprowadzone wcześniej restrykcje.
– Przykład Irlandii pokazuje, że otwarty model organizacji rynku aptecznego jest pacjentocentryczny, podczas gdy system zamknięty stawia w centrum uwagi interes i komfort aptekarza – zwrócił uwagę prawnik.
Przeregulowany rynek nie sprzyja innowacjom
Powołał się też na przeprowadzone przez Związek Pracodawców Aptecznych PharmaNET badanie, z którego wynika, że rynki apteczne Europy Środkowo-Wschodniej, na których dominuje tendencja liberalna, są jednocześnie dużo bardziej otwarte na wprowadzanie innowacyjnych usług dla pacjentów. Czechy i Rumunia najwięcej nowych usług w aptekach. Farmaceuci z tych krajów szczepią, udzielają wsparcia w rzucaniu palenia, diagnozują niektóre schorzenia i wykonują podstawowe badania profilaktyczne.
O ile przedstawiciele rynku we wszystkich analizowanych państwach zadeklarowali chęć wprowadzenia usług dodatkowych w podobnym zakresie (62,5 proc. respondentów wskazało gotowość do wprowadzenia wszystkich, a 37,5 proc. części usług, na których świadczenie w aptekach wyraziłby zgodę regulator), o tyle nie każdy będzie miał taką możliwość ze względu na stosunek rządu do nowych usług.
– Na rynku aptecznym, który jest zamknięty, zasadniczo tylko państwo inicjuje świadczenie określonych usług propacjenckich w aptekach. Przeregulowany rynek nie będzie więc innowacyjny. Niektórzy respondenci wprost wskazywali, że ograniczenia na rynku – inne niż rygorystyczne wymogi, co do kwalifikacji świadczących usługi – przekładają się na gorszą obsługę pacjentów – mówił mec. Marcin Tomasik.
Widać to także w Europie Zachodniej, gdzie otwarty rynek brytyjskich czy holenderskich aptek ma znacznie więcej do zaoferowania pacjentom pod względem ilości i jakości dodatkowych usług świadczonych w aptekach niż zamknięty rynek w Niemczech czy Francji.
W dyskusji panelowej poruszono także kwestię barier, jakie mogą pojawić się przy wprowadzaniu nowych usług, w tym szczepień, w aptekach. Ján Kyselovič z Uniwersytetu w Bratysławie przekonywał, że jedną z nich są niedobory kadrowe farmaceutów w aptekach. Innym wątkiem były bariery prawne, które mogą skutecznie uniemożliwić informowanie pacjentów o nowych usługach.
Przykładowo, obecnie w Polsce trwa dyskusja nad wprowadzeniem nowych świadczeń opieki farmaceutycznej oraz usług w aptekach. Z drugiej strony apteki mają faktyczny zakaz informowania o tym pacjentów.
– To oczywisty paradoks i jaskrawy przykład przeregulowania. Polski przykład daje innym państwom ważną lekcję dotyczącą konieczności uwzględnienia długofalowych skutków przy wprowadzaniu dalszych ograniczeń prawnych pod pozorem korzyści dla rynku i samych pacjentów – argumentował w dyskusji panelowej przedstawiciel ZPA PharmaNET.
Konferencja Europejskiej Federacji Sieci Aptecznych (EFPC) „Opieka farmaceutyczna - poza pandemią” odbyła się 10 marca równolegle w Bukareszcie i Pradze. Podczas połączeń online głos zabierali eksperci z Brukseli, Słowenii, Polski, Czech, Słowacji, Węgier i Rumunii.








