Brytyjska Rada Kosmetyczna (British Beauty Council) oraz Wspólna Rada ds. Praktyków Kosmetycznych (Joint Council for Cosmetic Practitioners, JCCP) od lat apelowały o zaostrzenie regulacji w tej dziedzinie. Obie organizacje wyraziły poparcie dla nowych zasad, uznając je za ważny krok w kierunku poprawy bezpieczeństwa pacjentów. Nowe regulacje wpisują się w szersze zmiany, które mają uporządkować branżę zabiegów niechirurgicznych (NSCPs), coraz popularniejszych, lecz do tej pory nie zawsze odpowiednio kontrolowanych.
Zgodnie z nowym stanowiskiem Rady Pielęgniarstwa i Położnictwa (Nursing and Midwifery Council, NMC), pielęgniarki i położne będą zobowiązane do przeprowadzenia osobistej konsultacji z pacjentem przed przepisaniem jakichkolwiek produktów stosowanych w celach estetycznych. Konsultacje zdalne – przez telefon, e-mail, wideorozmowę czy za pośrednictwem osób trzecich – nie będą już dopuszczalne. Obowiązkowe będzie również przeprowadzenie i udokumentowanie pełnej oceny klinicznej zarówno podczas pierwszej wizyty, jak i kolejnych.
Pielęgniarki i położne, które nie dostosują się do nowych przepisów po 1 czerwca, mogą zostać wykreślone z rejestru NMC. Wprowadzenie tych zasad poprzedziły badania i konsultacje społeczne przeprowadzone przez NMC w 2024 roku. Jak podkreśliła Anne Trotter, zastępczyni dyrektora ds. edukacji i standardów w NMC, zmiany te są konieczne dla zapewnienia większego bezpieczeństwa pacjentom. Podobne wytyczne wprowadziła już w 2012 roku General Medical Council, zakazując lekarzom przepisywania produktów do zabiegów estetycznych bez osobistej konsultacji, a w 2021 roku zakazano przeprowadzania zabiegów z użyciem botoksu i wypełniaczy u osób poniżej 18. roku życia.
Jak wygląda sytuacja w Polsce?
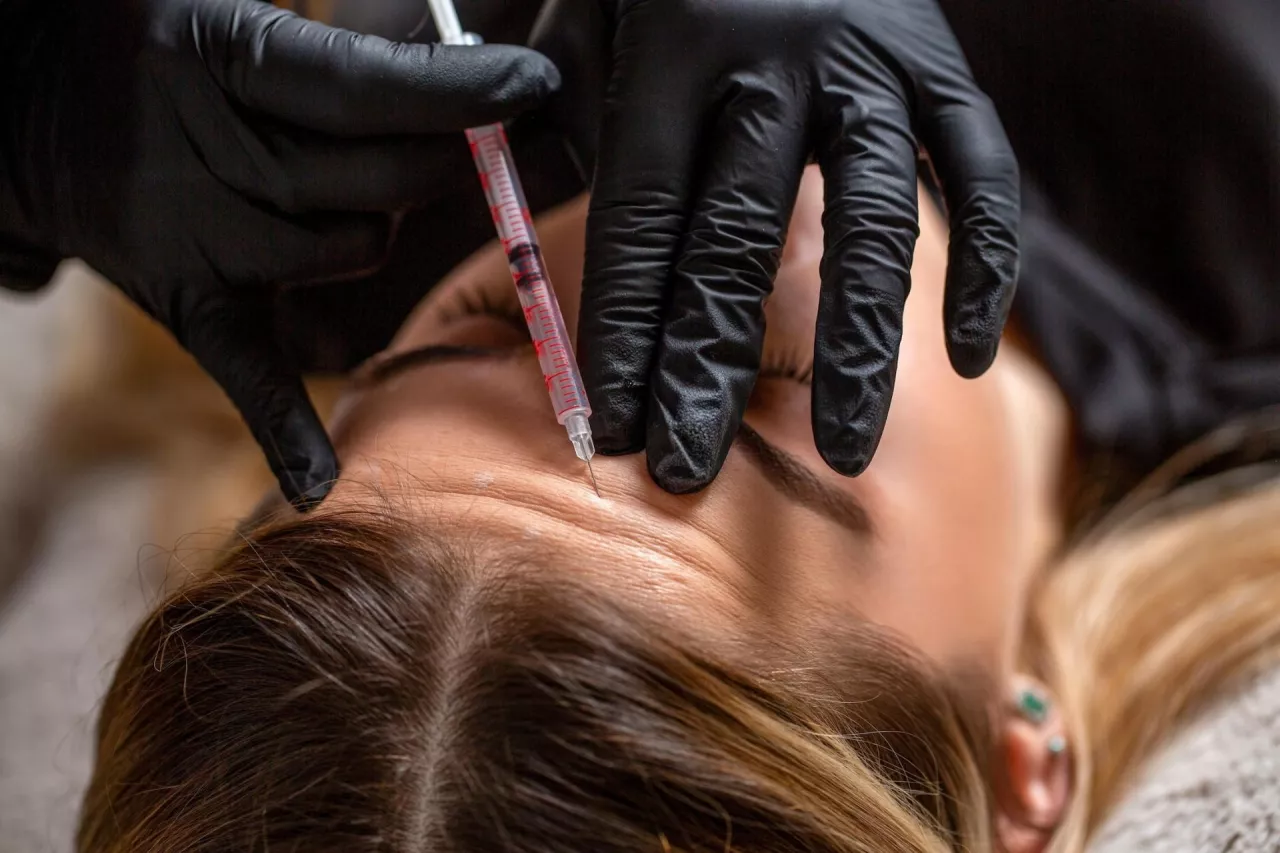
W Polsce stan prawny dotyczący podawania toksyny botulinowej (botoksu) i wypełniaczy, takich jak kwas hialuronowy, jest niejednoznaczny, co prowadzi do licznych kontrowersji i sporów między środowiskami lekarskimi a kosmetologicznymi. Toksyna botulinowa jest klasyfikowana jako produkt leczniczy dostępny wyłącznie na receptę (kategoria Rp). Zgodnie z przepisami ustawy Prawo farmaceutyczne, jej ordynowanie i podawanie jest zarezerwowane dla lekarzy posiadających prawo wykonywania zawodu. Podawanie toksyny botulinowej przez osoby niebędące lekarzami, takie jak kosmetolodzy czy kosmetyczki, jest niezgodne z prawem i może skutkować odpowiedzialnością karną.
W przypadku wypełniaczy na bazie kwasu hialuronowego sytuacja jest bardziej skomplikowana. Choć są one klasyfikowane jako wyroby medyczne, wielu producentów w instrukcjach użytkowania zastrzega, że powinny być stosowane wyłącznie przez lekarzy. Brak jednoznacznych przepisów prawnych w tym zakresie powoduje, że kosmetolodzy często wykonują zabiegi z ich użyciem, co budzi kontrowersje i obawy o bezpieczeństwo pacjentów. Obecnie w Polsce nie istnieje kompleksowa ustawa regulująca uprawnienia do wykonywania zabiegów z zakresu medycyny estetycznej. Ministerstwo Zdrowia pracuje nad katalogiem procedur zarezerwowanych dla lekarzy, jednak nie został on jeszcze opublikowany. W efekcie dochodzi do sytuacji, w których osoby nieposiadające odpowiednich kwalifikacji wykonują inwazyjne zabiegi, co może prowadzić do poważnych powikłań zdrowotnych.
Ze względu na brak jednoznacznych regulacji prawnych i potencjalne ryzyko powikłań, pacjenci powinni zachować ostrożność przy wyborze specjalisty do przeprowadzenia zabiegów z użyciem toksyny botulinowej czy wypełniaczy. Zaleca się korzystanie z usług lekarzy posiadających odpowiednie kwalifikacje i doświadczenie w zakresie medycyny estetycznej, co zwiększa bezpieczeństwo i skuteczność przeprowadzanych procedur.