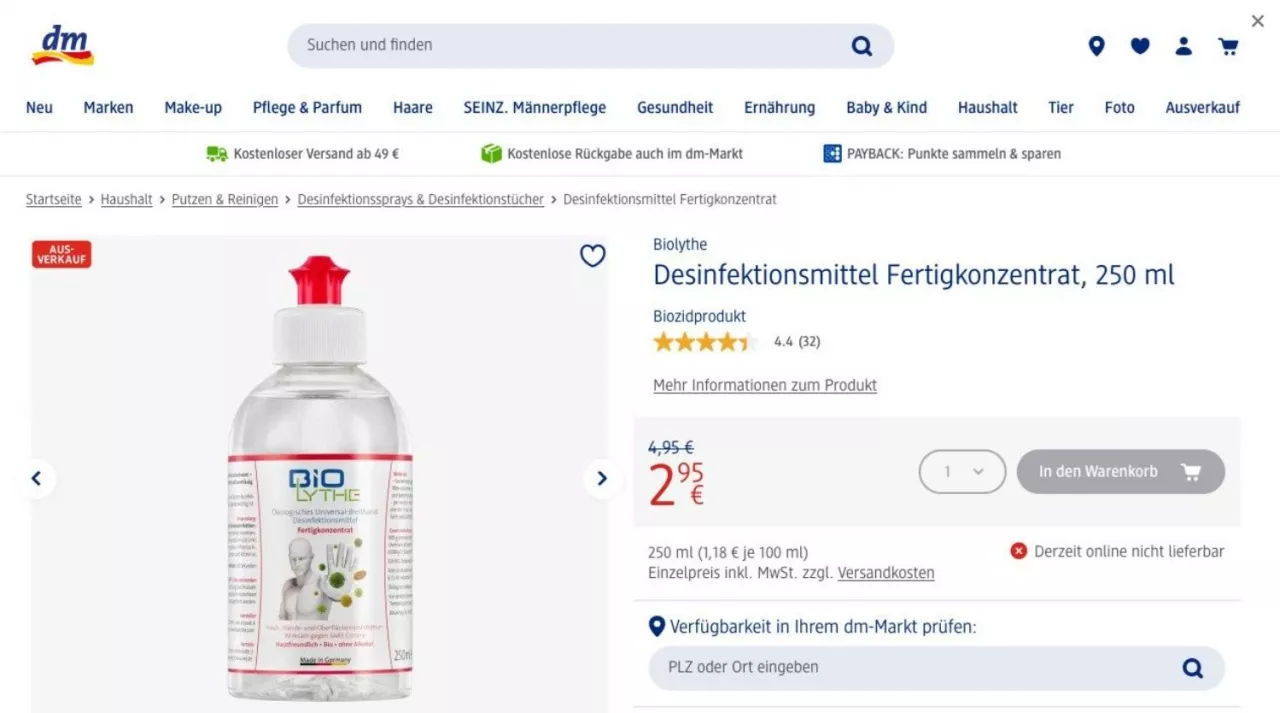
Sieć drogerii dm-Drogerie Markt GmbH & Co. KG (dm) podobnie jak wszystkie sieci handlowe w czasie pandemii wprowadziła do oferty środki do dezynfekcji rąk. Jednym z nich był środek dezynfekujący „Biolythe”. Na etykiecie tego produktu użyto następujących zwrotów: „ekologiczny uniwersalny środek dezynfekujący o szerokim spektrum działania”, „dezynfekcja skóry, rąk i powierzchni zewnętrznych”, „skuteczny przeciwko koronawirusowi SARS” oraz „przyjazny dla skóry, bio, bez alkoholu”.
Niemieckie stowarzyszenie zwalczania nieuczciwej konkurencji uważa, że jest to nieuczciwa reklama. Zdaniem tego stowarzyszenia dm naruszyła rozporządzenie w sprawie produktów biobójczych. W 2021 r. organizacja złożyła powództwo w tej sprawie do niemieckich sądów, chcąc uzyskać decyzję o zakazie oznaczania w ten sposób produktu lub jego wprowadzania do obrotu z takim opisem.
Zgodnie z rozporządzeniem produkty biobójcze nie mogą być reklamowane w sposób wprowadzający użytkownika w błąd co do ryzyka, jakie mogą stwarzać dla zdrowia, środowiska lub co do ich skuteczności. Reklama produktu biobójczego nie może zawierać zwrotów „produkt biobójczy niskiego ryzyka”, „nietoksyczny”, „nieszkodliwy”, „naturalny”, „przyjazny dla środowiska”, „przyjazny dla zwierząt” ani jakichkolwiek podobnych wskazań.
Jak podawała niemiecka prasa, w 2021 r., Sąd Rejonowy w Karlsruhe uznał opis produktu za wprowadzający w błąd, uzasadniając, że terminy takie jak „organiczny”, „ekologiczny” i „przyjazny dla skóry” podsuwają konsumentom wyobrażenia, których środek dezynfekujący nie oddaje w pełni. „Organiczny”, zwłaszcza w połączeniu z „przyjaznym dla skóry”, kojarzy się ze „zdrowym”, zatem konsumenci będą oczekiwać pozytywnych efektów jego stosowania. Zdaniem sędziów również odniesienie do środowiska wprowadzało konsumentów w błąd, ponieważ „Organiczny/ekologiczny” kojarzy się z przekonaniem, że produkt jest czysto naturalny i nie zawiera żadnych substancji chemicznych. Tymczasem produkt zawierał 4,5 g elektrochemicznie aktywowanej soli NaCl, 0,49 g podchlorynu sodu Na+OCI-, 0,008 g O2 i 0,004 g O3.
Dm złożyło wówczas odwołanie od wyroku i kolejną instancją był Wyższy Sąd Krajowy w Karlsruhe (OLG).
Federalny trybunał sprawiedliwości, rozpatrujący sprawę dotyczącą konkretnie zwrotu „przyjazny dla skóry”, zwrócił się do Trybunału Sprawiedliwości UE z pytaniem prejudycjalnym. Sąd ten zmierza do ustalenia, czy zwrot „jakichkolwiek podobnych wskazań” obejmuje wszelkie wskazania, które, podobnie jak wyżej wymienione zwroty wyraźnie wymienione w rozporządzeniu, minimalizują ryzyko, jakie produkt biobójczy może stwarzać dla zdrowia lub środowiska lub w odniesieniu do jego skuteczności, nie mając przy tym charakteru ogólnego.
Obecnie Trybunał UE stwierdził (wyrok Trybunału w sprawie C-296/23 | dm-drogerie markt), że rozporządzenie nie zawiera żadnej wskazówki, zgodnie z którą zakaz stosowania w reklamie produktów biobójczych jest ograniczony wyłącznie do wskazań ogólnych. Tak więc zarówno wskazanie ogólne, jak i wskazanie szczególne minimalizujące ryzyko, jakie produkty te mogą stwarzać, mogą wprowadzać konsumenta w błąd co do istnienia takiego ryzyka. W konsekwencji zwrot „jakichkolwiek podobnych wskazań” obejmuje wszelkie wskazania w reklamie produktów biobójczych, które odnoszą się do tych produktów w sposób mogący wprowadzać użytkownika w błąd, minimalizując to ryzyko, a nawet zaprzeczając jego istnieniu, nie mając przy tym koniecznie charakteru ogólnego.
W przypadku zwrotu „przyjazny dla skóry”, Trybunał zauważył, że ma on pozytywną konotację unikającą przywołania jakiegokolwiek ryzyka, w związku z czym może nie tylko relatywizować szkodliwe skutki uboczne danego produktu, ale również sugerować, że może on nawet być korzystny dla skóry. Zwrot ten ma charakter wprowadzający w błąd, co uzasadnia zakaz jego stosowania w reklamie przedmiotowego produktu biobójczego.
Odesłanie prejudycjalne pozwala sądom państw członkowskich, w ramach rozpatrywanego przez nie sporu, zwrócić się do Trybunału z pytaniem o wykładnię prawa Unii lub o ocenę ważności aktu Unii. Trybunał nie rozpoznaje sporu krajowego. Do sądu krajowego należy rozstrzygnięcie sprawy zgodnie z orzeczeniem Trybunału. Orzeczenie to wiąże w ten sam sposób inne sądy krajowe, które spotkają się z podobnym problemem.
Obecnie Biolythe nie jest dostępny w dm.